Die Suche nach einem Wirkstoff, der gezielt Schlüsselspieler krankheitsauslösender Prozesse angreift, steht immer am Anfang der Entwicklung eines jeden Medikaments. Doch das perfekte Medikament, das nur ein Ziel im Körper ausschaltet, gibt es nicht: keine Wirkung ohne Nebenwirkung, wie auch den meisten Beipackzetteln zu entnehmen ist. Forschende um Prof. Herbert Waldmann und Dr. Slava Ziegler am Max-Planck-Institut für molekulare Physiologie in Dortmund haben nun für eine Gruppe von bereits charakterisierten Wirkstoffen eine unerwartete Wirkung identifiziert: Sie fehlregulieren allesamt den Cholesterinstoffwechsel, ein hausgemachtes Problem, wie es scheint.
Als Alexander Flemming 1928 einen Schimmelpilz auf einer mit Bakterien bewachsenen Kulturplatte entdeckte, hatte er nicht damit gerechnet, einen der meist verwendeten Wirkstoffe zu finden: das Penicillin. Zufällige Entdeckungen wie diese, und die Identifizierung von Wirkstoffen aus traditionellen Heilmitteln, wie das Morphium des Schlafmohns, haben lange Zeit die Entdeckung neuer Medikamente geprägt.
Moderne Wirkstoffsuche mit System
In der Zwischenzeit gab es rasante Entwicklungen in der Chemie und der Molekularbiologie, die mittlerweile eine systematische und zielgerichtete Suche nach potentiellen Wirkstoffen ermöglichen. So konnten zunächst durch Fortschritte auf den Gebieten der organischen und besonders der kombinatorischen Chemie riesige Molekülbibliotheken hergestellt und in Hochdurchsatz-Tests auf ihre pharmakologische Wirkung geprüft werden.
Mit der vollständigen Sequenzierung des menschlichen Genoms und der Entwicklung neuer molekularbiologischer Methoden konnten krankheitsrelevante zelluläre Prozesse sowie ihre molekularen Schlüsselspieler ausfindig gemacht werden. So ist man mittlerweile dazu übergegangen, große Substanzbibliotheken im Hochdurchsatzverfahren auf ihre Wirkung auf relevante Zielmoleküle, meist Proteine, zu screenen. Die positiv identifizierten Substanzen, sogenannte Hits, werden anschließend in ihrer chemischen Struktur zu Leitstrukturen optimiert, die bereits in geringen Dosen wirksam sind und gut im Körper aufgenommen und verteilt werden.
Keine Wirkung ohne Nebenwirkung
Diese zielgerichtete Wirkstoffentwicklung ist sehr erfolgreich bei der Identifizierung neuer Wirkstoffkandidaten, die meist die Funktion der Zielproteine oder ihre Interaktion mit anderen Proteinen verhindern. Jedoch greifen die gefundenen chemischen Substanzen sehr häufig auch andere, verwandte Proteine an, die eine ähnliche Funktion oder Struktur haben.
„Es kommt nicht selten vor, dass ein zunächst Erfolg versprechender Wirkstoffkandidat erst spät in der langjährigen Entwicklung schwerwiegende Nebenwirkungen zeigt und somit der klinische Einsatz eingeschränkt oder gar verhindert wird.“
— Slava Ziegler
Auf der Suche nach unbekannten Bioaktivitäten
Um möglichen Nebenwirkungen von potentiellen Wirkstoffkandidaten auf die Spur zu kommen, wird bei der Wirkstoffentwicklung in einer Reihe von Testverfahren ihre Wirkung auf bekannte Proteinklassen, biologische Prozesse und bestimmte Zelleigenschaften untersucht. Da jedoch die Anzahl der bekannten Zielmoleküle in der Zelle begrenzt ist, können auch diese Testverfahren nur die erwartete Bioaktivität wiedergeben. Sogenannte Profilierungs-Ansätze bieten mittlerweile die Möglichkeit, ein größeres Wirkspektrum einer Substanz zu erfassen. Bei diesen unvoreingenommenen Testverfahren werden simultan hunderte zelluläre oder genetische Parameter in einem Profil erfasst, das mit Profilen von Referenz-Wirkstoffen mit bereits bekannten Wirkungen verglichen wird.
Wenn die Wirkstoff-Profile übereinstimmen
In ihrer neusten Forschungsarbeit hat die Gruppe um Herbert Waldmann und Slava Ziegler zwei Profilierungs-Ansätze kombiniert, um bioaktive Substanzen aus einer Substanzbibliothek mit ca. 15000 Naturstoff-inspirierten Molekülen zu identifizieren und sie mit den Profilen von bekannten Wirkstoffen zu vergleichen. Mit dem „Cell Painting“ Ansatz, in dem mehrere funktionelle Bereiche der Zelle gefärbt und anschließend mikroskopisch auf Veränderungen untersucht werden, konnte ein großer Cluster von Substanzen mit ähnlichen Profilen ausgemacht werden.
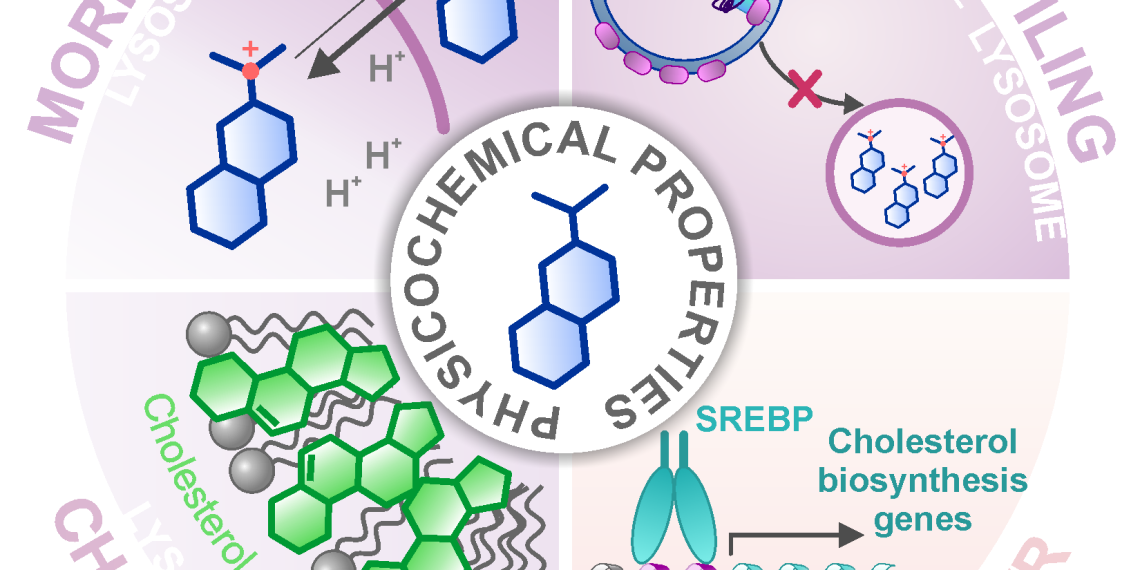
Eine Vorhersage über die Wirkweise des Clusters war jedoch nicht möglich, da diese Referenzsubstanzen sehr unterschiedliche Aktivitäten, also Zielmoleküle, aufwiesen. Mit einer anschließenden Suche mittels Proteom-Profilierung, bei der die Mengen tausender Proteine und ihre Regulation quantifiziert wird, konnten die Forschenden den Cluster auf eine für die meisten Referenzsubstanzen ungeahnte biologische Aktivität eingrenzen: die Fehlregulation der Cholesterinhomöostase.
Zwei Fliegen mit einer Klappe: neue Bioaktivitäten und Nebenwirkungen identifizieren
Doch wie können so viele Substanzen, die unterschiedlichste Zielmoleküle im Körper angreifen, die gleiche Wirkung auslösen? Die Forschenden konnten zeigen, dass die meisten Substanzen des Clusters im Lysosom akkumulieren, einem Organell, in dem das Cholesterin für seine weitere Funktion in der Zelle zwischengelagert wird. Das Lysosom weist einen niedrigeren pH-Wert als der Rest der Zelle auf, und dieser ist von entscheidender Bedeutung für das Funktionieren der lysosomalen Verdauungsenzyme, die fremde und eigene Biomoleküle verarbeiten.
Im Lysosom erhöhen die Substanzen aus dem beschriebenen Cluster den pH-Wert und stören somit die Funktion dieses Organells und insbesondere den Cholesterinhaushalt der Zelle. Dass sich die Substanzen im Lysosom anlagern, ist nicht auf ein konkretes Zielmolekül im Lysosom sondern auf ihre chemischen und physikalischen Eigenschaften zurückzuführen, die sie durch ihre strukturelle Optimierung für eine verbesserte Löslichkeit erhalten haben.
„Interessanterweise wurde ein gestörter Cholesterinhaushalt bereits mit einigen auf dem Markt erhältlichen Medikamenten in Verbindung gebracht, wie z. B. Psychopharmaka,“ stellt Tabea Schneidewind, Erstautorin der Studie, fest. „Mit der Kombination der beiden Suchstrategien können wir zwei Fliegen mit einer Klappe schlagen: dem Grund für Nebenwirkungen auf die Spur kommen und neue Wirkstoffe und Wirkmechanismen identifizieren“, fasst Slava Ziegler zusammen.
Cholesterinhaushalt könnte womöglich auch SARS-CoV2-Infektionen beeinflussen
Eine Beeinflussung des Cholesterinhaushalts scheint eine häufige Wirkung von vielen chemischen Substanzen zu sein und sollte bei der Bewertung von Nebeneffekten von Wirkstoffen berücksichtigt werden. Die beobachtete Aktivität ist jedoch nicht per se unerwünscht. Derzeit werden bekannte Wirkstoffe auf die Hemmung der SARS-CoV-2-Infektion von Wirtszellen untersucht.
„Viele Wirkstoffe aus unserem Cluster sind in verschiedenen Studien als Sars-CoV-2-Hemmer identifiziert worden. Interessanterweise zeigen andere Forschungsergebnisse, dass Membrancholesterin und somit eine unbeeinträchtigte Cholesterinhomöostase wichtig für die Corona-Virus-Infektion sind. Unsere Daten erklären womöglich den Grund für die Wirkung dieser Substanzen gegen Sars-CoV‑2: Sie verändern die Biosynthese und Verteilung von Cholesterin in der Zelle, was die Virusinfektion stört.“ betont Slava Ziegler.