Ein internationales Forscherteam um Dr. Michael R. Kreutz und Dr. Marina Mikhaylova vom Leibniz-Institut für Neurobiologie Magdeburg (LIN), dem Zentrum für Molekulare Neurobiologie Hamburg (ZMNH) und der Humboldt-Universität Berlin sowie Dr. Eunjoon Kim vom Korea Advanced Institute of Science and Technology (KAIST) hat die Auswirkungen von Mutationen im Autismus-Risikogen SHANK3 auf molekularer Ebene entschlüsselt. Das Projekt wurde im Wettbewerbsverfahren der Leibniz-Gemeinschaft gefördert und ist im Fachjournal Elife publiziert.
 Im Road Movie „Rain Man“ von 1988 spielte Dustin Hoffmann in einer seiner Paraderollen einen inselbegabten Autisten, angelehnt an das Leben des bekanntesten Savants, Kim Peek. Autismus ist eine komplexe Entwicklungsstörung des Gehirns, die mit Besonderheiten in der Wahrnehmung und Bewertung von Sinnesreizen einhergeht. Autistischen Menschen fällt es schwer, mit anderen Menschen zu kommunizieren und sozial zu interagieren, sie flüchten sich oft in stereotype Verhaltensmuster und haben manchmal auch kognitive Probleme oder Inselbegabungen.
Im Road Movie „Rain Man“ von 1988 spielte Dustin Hoffmann in einer seiner Paraderollen einen inselbegabten Autisten, angelehnt an das Leben des bekanntesten Savants, Kim Peek. Autismus ist eine komplexe Entwicklungsstörung des Gehirns, die mit Besonderheiten in der Wahrnehmung und Bewertung von Sinnesreizen einhergeht. Autistischen Menschen fällt es schwer, mit anderen Menschen zu kommunizieren und sozial zu interagieren, sie flüchten sich oft in stereotype Verhaltensmuster und haben manchmal auch kognitive Probleme oder Inselbegabungen.
Am Entstehen von Autismus können genetische Mutationen beteiligt sein. Die betroffenen Genprodukte sind wichtige Proteine in den Synapsen des Gehirns, wie das SHANK3-Molekül. SHANK3 ist ein Gerüst-Protein, welches viele Bindungsstellen für andere Proteine enthält und als eine Art Master-Organizer für die postsynaptische Proteinmaschinerie fungiert: Es verknüpft Transmitterrezeptoren, Signalmoleküle und das Zytoskelett und ist unverzichtbar für die präzise Arbeit der Synapsen.
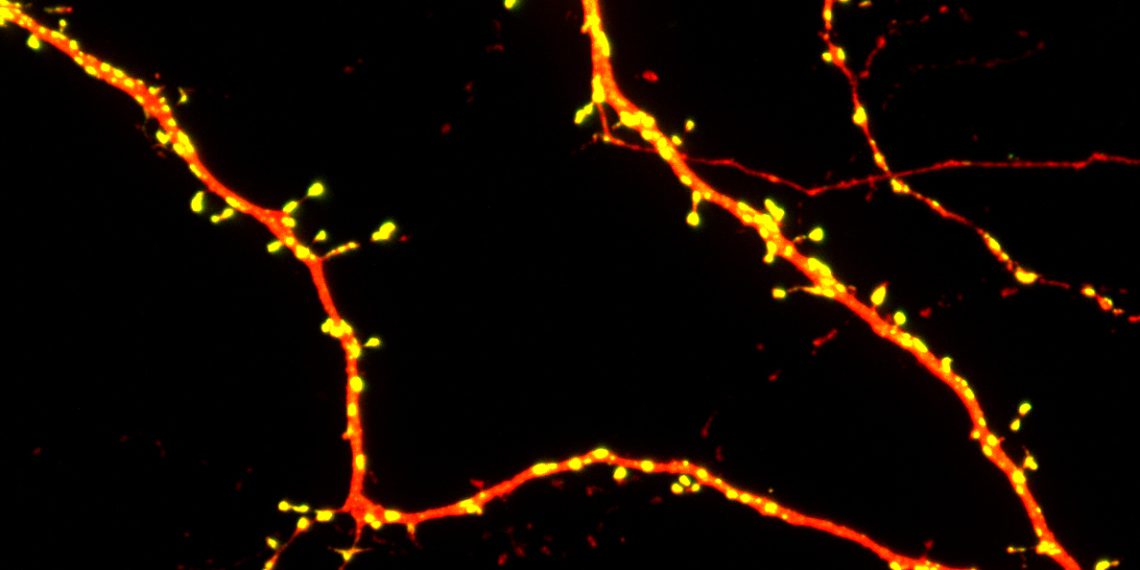
Welche Auswirkungen haben die bei autistischen Patienten gefundenen Mutationen auf die Funktionsweise des SHANK3-Proteins? Michael Bucher, ein Doktorand in den Arbeitsgruppen von Michael R. Kreutz und Marina Mikhaylova hat in enger Zusammenarbeit mit dem Labor von Kim vom südkoreanischen Advanced Institute of Science and Technology für zwei dieser Mutationen die defekten Proteine mittels Gentechnik nachgebaut und ihre Struktur analysiert. Mit biophysikalischen Verfahren konnte das Forscherteam nachweisen, dass die Mutationen zu Veränderungen in der dreidimensionalen Proteinstruktur führen, die weitreichende Konsequenzen haben: Die mutierten Proteine gelangen in den Nervenzellen weniger in die Synapsen, wodurch die synaptische Funktion gestört wird.
„Wir konnten sehen, dass die Mutationen so veränderten, dass es die Ordnung und Dynamik der Proteine in erregenden Synapsen nicht mehr organisieren konnte. Damit haben wir molekular entschlüsselt, warum bei Patienten, die diese Mutationen tragen, Störungen in den synaptischen Verknüpfungen entstehen, die z.B. für die kognitiven Symptome verantwortlich sein könnten“
‑Michael Bucher, Erstautor der Studie