Demenzerkrankungen sind eine große Belastung vor allem für ältere Menschen. Nach Angaben des Arzneimittelherstellers Novartis leiden allein in Deutschland rund eine Million Menschen daran; Alzheimer hat dabei einen Anteil von rund 70 Prozent. Weil die Menschen immer älter werden, steigt die Zuwachsrate exponentiell. Hoffnung machen Forschungserfolge – und ein bedeutendes Resultat kommt jetzt aus der Universität Bremen: Die Zellbiologin Professorin Janine Kirstein und ihre Arbeitsgruppe haben in Fadenwürmern die „Nervenzelle 0“ gefunden – also die Nervenzellen, in der die Alzheimer-Erkrankung beginnt. Weil sich die Ergebnisse auf den Menschen übertragen lassen, könnten jetzt gezieltere Ansatzpunkte zur Verhinderung oder Verlangsamung der Krankheit entwickelt werden.
„Im Alterungsprozess des Menschen kommt es in unseren Nervenzellen in steigendem Maße zu Fehlern“, erläutert die Bremer Hochschullehrerin. „Bei Alzheimer kommt es beispielsweise zunehmend zu einer Anhäufung von fehlgefalteten Proteinen, die dann verklumpen und längliche, seilartige Strukturen ausbilden.“ Diese „Zugseil-Strukturen“ können große Hirnareale befallen und führen schließlich zu Erkrankungen wie Alzheimer oder auch Parkinson – und im schlimmsten Falle zur Demenz mit allen verbundenen kognitiven Beeinträchtigungen.
„Nervenzelle 0“ identifiziert
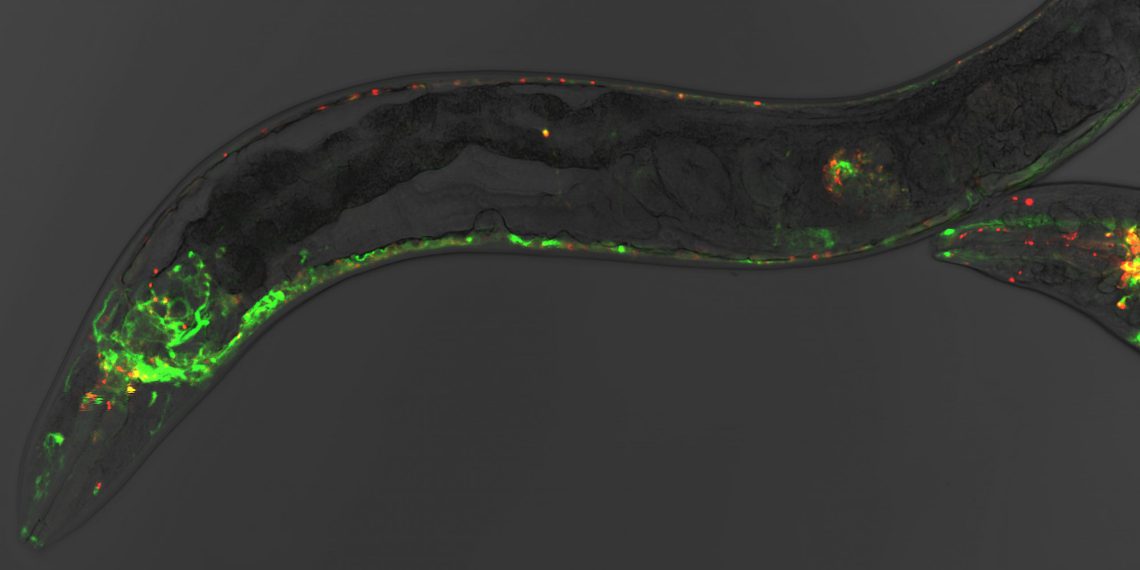
Bei der Forschung ist es Janine Kirstein und ihrer Arbeitsgruppe nun gelungen, diesen Prozess sichtbar zu machen und vor allem den „Startpunkt“ der Krankheit – die „Nervenzelle 0“ – zu identifizieren. „Fadenwürmer eigenen sich deshalb sehr gut, weil sie auf molekularer Ebene identisch zum Menschen sind. Sie sind zudem transparent, weshalb die Vorgänge durch Fluoreszenz-Farbstoffe sichtbar gemacht werden können.“ Im Verlauf der Forschungen entdeckte die Gruppe, in welchen Zellen die Verklumpung zuerst auftritt.
Ein Vorteil ist dabei, dass der Lebenszyklus des Fadenwurmes von der Geburt bis zum Tod nur einen Monat beträgt: „Am Menschen verbieten sich solche Forschungen aus ethischen Gründen, und selbst bei einer Maus würde der Zyklus zwei Jahre dauern“, so Janine Kirstein. Im Fadenwurm hingegen laufen die Vorgänge schnell ab und lassen sich im Tagesrhythmus beobachten.
Forschungsresultate legen Marker-Entwicklung nahe
Die Ergebnisse aus der Forschung der Bremer Arbeitsgruppe lassen es nun zu, auch beim Menschen gezielt auf die Nervenzellen zu fokussieren, in der neurodegenerative Erkrankungen wie Alzheimer beginnen. „Man könnte zum Beispiel einen Marker entwickeln, der einen Rückschluss darüber zulässt, ob die Degeneration bereits begonnen hat“, so die Professorin. „Dementsprechend schneller könnte man dann handeln, um weitergehende Folgen zu vermeiden.“
Ihre Ergebnisse hat die Arbeitsgruppe jetzt in „Progress in Neurobiology“ – der führenden neurobiologischen Fachzeitschrift – publiziert. Kurzfristig haben Janine Kirstein und ihre Kolleginnen und Kollegen daraufhin bereits durch den Alzheimer Forschung Initiative e.V. eine Anschubfinanzierung von 50.000 € zugesprochen bekommen, um mit diesen Mitteln weiterführende Projekte entwickeln zu können.
Zum fachlichen Hintergrund
Die Alzheimer Krankheit wird durch die Fibrilisierung des Abeta Peptids und des tau Proteins hervorgerufen. Abeta Peptide entstehen bei jedem Menschen, aber nur ein relativ kleiner Bevölkerungsanteil erkrankt an Alzheimer. Der größte Risikofaktor ist das Alter. Bei den über 80-Jährigen beträgt der Anteil der Alzheimer-Erkrankten 20%; er stiegt auf 30 bis 50% bei den 85-Jährigen. Die Einzelmoleküle sind harmlos; erst wenn sie sich zusammenlagern, können sie toxische Aggregate bilden.
In den vergangenen Jahren zeigte sich, dass sich die Aggregation des Abeta Peptids über das gesamte Gehirn ausbreiten kann. Setzt sich diese Kaskade einmal in den Gang, kann man sie nicht mehr aufhalten oder gar umkehren. Bisher wusste man lediglich, dass die ersten fibrilären Abeta-Aggregate in der Großhirnrinde und im Hippocampus des Gehirns auftreten. Wo genau die Aggregation beginnt, war jedoch unbekannt.
Der Arbeitsgruppe von Janine Kirstein gelang es nun, ein neues Tiermodell der Alzheimer-Erkrankung im Fadenwurm Caenorhabditis elegans zu generieren. Mit Hilfe dieses Krankheitsmodells konnten ihre Mitarbeiter zeigen, dass die Aggregation des Abeta Peptids in genau sechs Nervenzellen – den IL2-Neuronen – beginnt und sich von dort aus systematisch auf alle Nervenzellen ausweitet.
Wäre es nun auch möglich, den Prozess der Übertragung auf die anderen Nervenzellen zu unterdrücken? Der Nematode ist genetisch leicht zugänglich und erlaubt zellspezifische Manipulationen. Die AG Kirstein zeigte, dass eine gezielte Inhibition der Abeta Aggregation in den IL2-Neuronen in der Tat die Aggregationskaskade und Übertragung auf andere Neuronen verlangsamt. Zudem konnte eine Reduktion der Toxizität und einer Erhöhung der medianen Lebensspanne beobachtet werden.